浙江省人民医院康复医学科叶祥明团队在中科院一区TOP期刊发表重要研究成果
5月28日,我院康复医学科叶祥明主任医师团队联合安徽医科大学在Research(中科院1区TOP, IF: 10.7)发表了题为《Targeting ApoE-KCC2 Signaling Rescues GABAergic Synaptic Dysfunction and Depression-like Behaviors in Mice》的研究论文。该研究通过构建慢性社交挫败应激(CSDS)小鼠模型,结合行为学测试、病毒介导的基因调控、电生理记录、化学遗传学技术及分子生物学分析等技术,首次揭示了海马区ApoE通过调控K⁺-Cl⁻共转运体2(KCC2)的表达维持GABA突触功能,进而影响应激诱导的小鼠抑郁样行为的可能分子机制。研究发现,CSDS导致海马区ApoE表达下调,进而通过介导ApoE受体相关通路降低KCC2蛋白稳定性,最终损害GABA能突触抑制功能,并导致小鼠出现抑郁样行为;而靶向激活海马区GABA能神经元,增强KCC2功能或过表达ApoE均可显著逆转上述病理表型。该研究不仅阐明了ApoE-KCC2信号通路在抑郁症中的关键作用,还为开发新型抗抑郁药物提供了潜在靶点。
抑郁症是最常见的心理障碍之一,尤其在年轻人中发病率极高。其病理机制复杂,涉及多种生物因素与环境因素的相互作用,但抑郁症的病理机制仍不完全清楚。载脂蛋白E(Apolipoprotein E, ApoE)是一种关键的脂质转运蛋白,是众多神经精神疾病遗传风险基因。其表达和功能异常与神经功能障碍密切相关。研究发现,抑郁症患者脑内GABA水平显著降低,GABA突触功能受损。然而,ApoE如何调控GABA突触功能及慢性应激诱导的小鼠抑郁样行为的机制,一直是神经精神疾病研究领域的重要科学瓶颈。

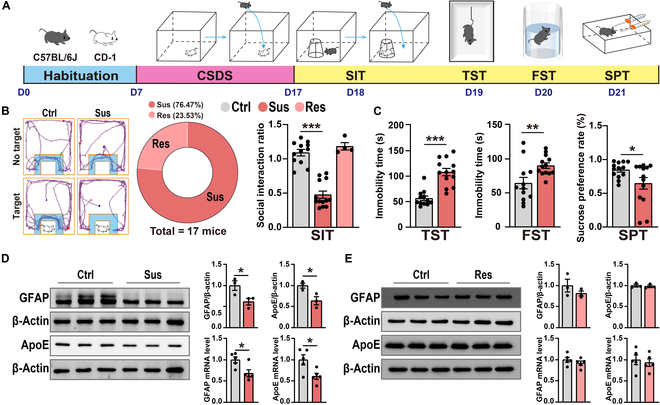
叶祥明研究团队首先建立了慢性社会挫败应激(CSDS)小鼠模型,通过为期10天的社交挫败应激成功诱导出抑郁样行为。通过社交互动测试(SIT)将小鼠分为易感组(Sus)和抵抗组(Res),其中Sus组小鼠表现出明显的社交回避行为(SIR<1)。进一步的行为学测试显示,Sus组小鼠在强迫游泳测试(FST)和悬尾测试(TST)中的不动时间显著延长,同时蔗糖偏好率明显降低,这些结果均表明抑郁小鼠的成功建模。分子水平检测发现,Sus组小鼠海马区星形胶质细胞标志物GFAP和ApoE的mRNA和蛋白水平均表现出明显的下调(如图1所示),提示CSDS诱导的抑郁样行为与海马区特异性ApoE表达下调密切相关。
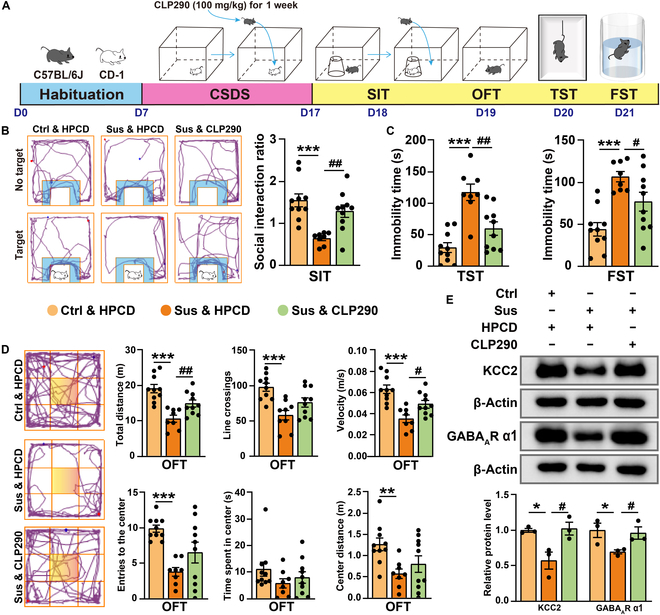
为探究KCC2在抑郁样行为中的作用,研究团队在CSDS建模过程中连续7天腹腔注射KCC2激活剂CLP290(100 mg/kg)。CLP290处理显著提高了Sus组小鼠的社交互动比(SIR)。在行为学测试中,CLP290组小鼠在TST和FST中的不动时间明显短于溶剂对照组,旷场实验(OFT)中的运动活动也得到显著改善。分子机制研究表明,CLP290处理显著上调了海马区KCC2和GABAA受体α1亚基的蛋白表达水平(如图2所示)。值得注意的是,研究者发现CLP290对特异性敲低海马中ApoE诱导的小鼠的抑郁样行为同样具有一定改善作用。结果提示增加KCC2表达能够改善应激诱导或ApoE缺失诱导的小鼠抑郁样行为。
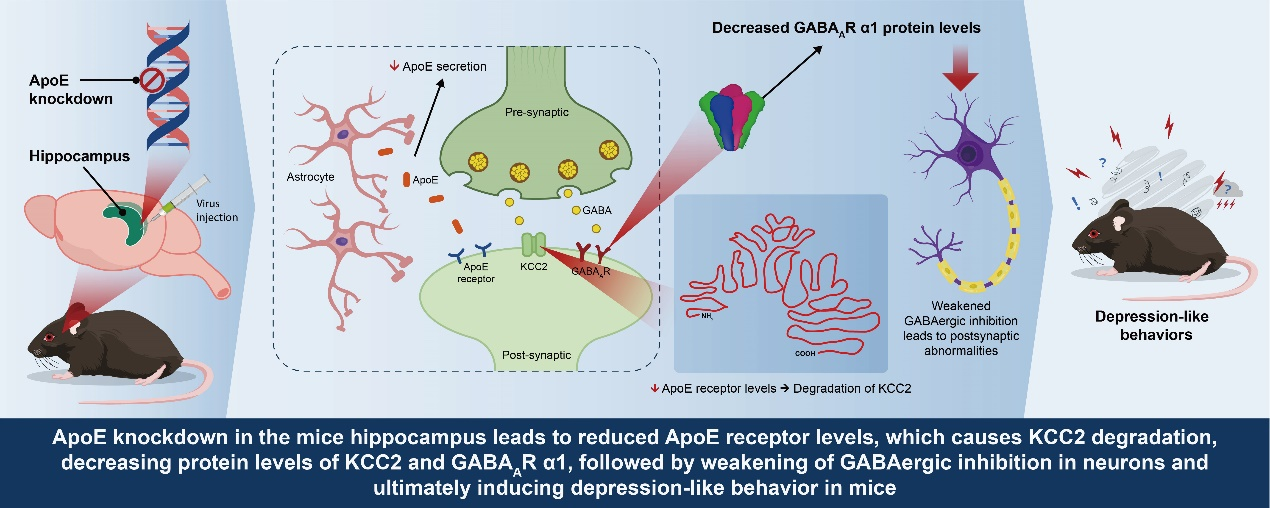
本研究揭示了"ApoE通过调控KCC2介导的GABA突触功能,在抑郁症病理机制中发挥关键作用。ApoE缺失导致ApoE受体通路异常从而促进KCC2降解,削弱GABA抑制作用,最终诱发抑郁样行为。"通过激活KCC2或海马中GABA能神经元,可有效改善上述病理,为开发新型抗抑郁药物提供了潜在靶点。此外,开发特异性靶向KCC2的小分子药物,可能为抑郁症治疗和康复带来新突破。

 WAP版
WAP版 客户端
客户端 融媒矩阵
融媒矩阵 企业邮箱
企业邮箱